研究内容の詳細
- 1. 自然免疫と獲得免疫の連鎖~人工アジュバントベクター細胞(エーベック)の免疫研究~
- 2. 記憶免疫の解明
- 3. ネオ抗原に着目した免疫誘導・治療法の開発
- 4. 感染症プロジェクト~COVID-19における交差反応性T 細胞研究~
1. 自然免疫と獲得免疫の連鎖 ~人工アジュバントベクター細胞(エーベック)の免疫研究~
自然免疫系リンパ球と樹状細胞の相互活性を中心とした自然免疫による免疫応答カスケードのトリガーから、獲得免疫、記憶免疫への誘導機構における免疫連鎖に着目した基礎研究(図2)と、それを利用した免疫療法についてのトランスレーショナル研究を進めています。特にこのような免疫系を人為的に効率的に動かす為に、生体内に存在する樹状細胞機能を最大限利用できる人工アジュバントベクター細胞(artificial adjuvant vector cells(エーベック)) を考案し、開発を進めています。
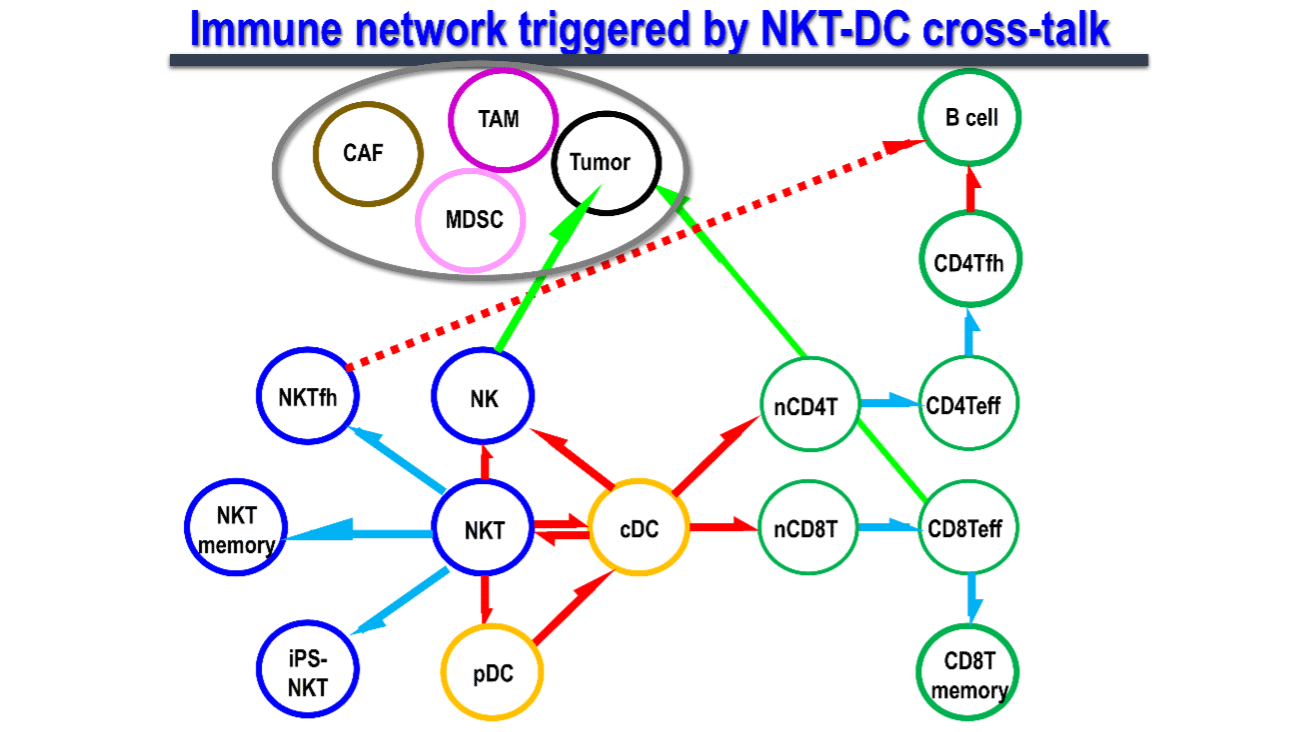
1.1. NKT 細胞 と樹状細胞の相互作用メカニズム
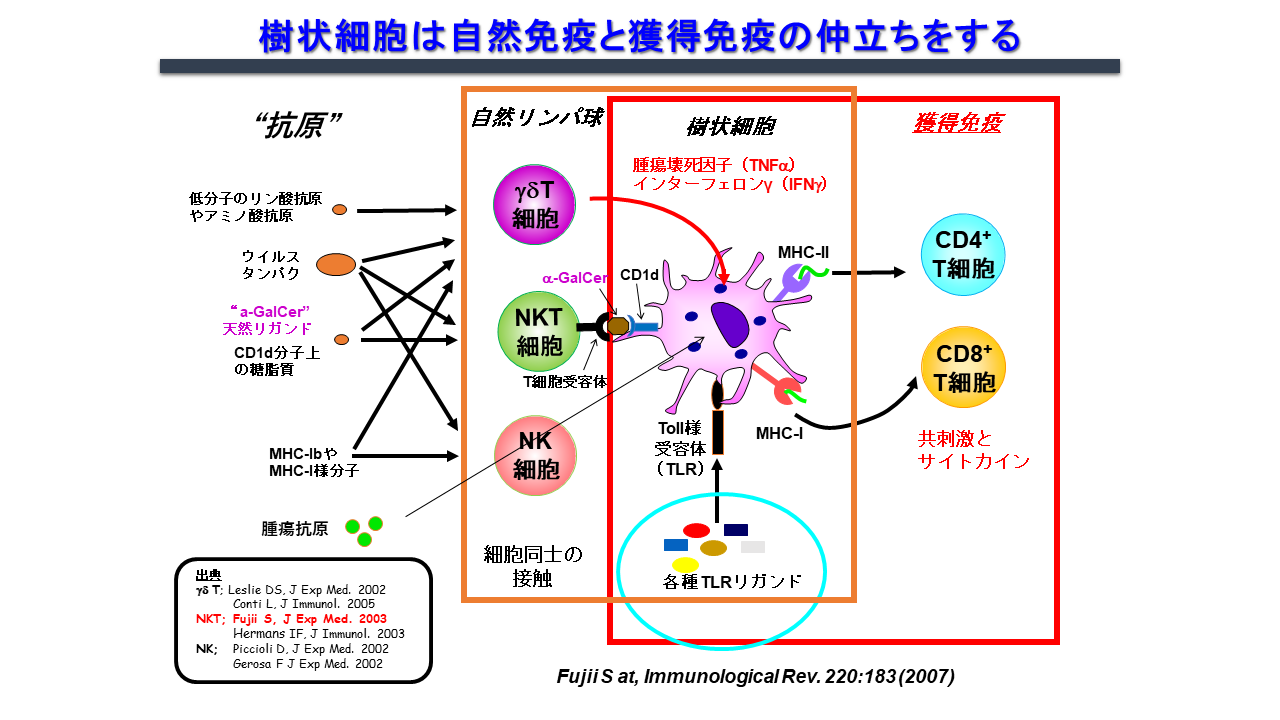
自然免疫と獲得免疫をリンクする上で司令塔となる樹状細胞は、活性化、成熟化することで抗原特異的な免疫を誘導します。その成熟化シグナルとしては従来Toll様シグナルが主に研究されてきました。しかしながら、我々は2003年にNKT細胞が樹状細胞を細胞間の相互作用を経て樹状細胞を活性化させる現象を世界で最初に発見しました(図3)。
NKT細胞は自然免疫系の一種で、T細胞とNK細胞の両方の受容体を発現している免疫調節細胞です。リンパ節には少ないものの、主に肝臓、脾臓、肺、骨髄などの臓器に存在します。T細胞受容体(TCR)のα鎖に可変性のないインバリアント鎖(マウスではVα14Jα18、ヒトではVα24Jα18)を発現するNKT細胞、通称iNKT細胞は、CD1d分子上に提示された糖脂質抗原を認識します。その代表的な糖脂質抗原がα-GalCerです。CD1d分子はヒトにおいては同一で、マウスーヒト間でも相同性が高く、ヒトiNKT細胞もマウスiNKT細胞と同様にα-GalCerを認識して活性化します。iNKT細胞が生体内で活性化すると図に示すように樹状細胞の成熟化を始め、複数の免疫細胞が活性化されることがマウスモデルで分かりました3, 4)。また、ヒトiNKT細胞もin vitroや免疫不全マウスに移植した実験系で同様の免疫応答を起こします。つまり、マウスモデルでの研究がヒトの臨床応用に反映し得ると言えます。
1.2. 人工アジュバントベクター細胞(エーベック)の免疫機構
がんワクチンは、手術、化学療法、放射線療法に対して抵抗性を示すがんに対するがん治療、更に再発予防療法として利用できますが、それぞれ課題があります。例えば、細胞療法の一つの樹状細胞療法では、効率的な樹状細胞成熟化が難しく、患者由来の樹状細胞採取や樹状細胞培養工程に困難が伴い、培養工程等に起因する高額な医療費も問題です。ペプチドワクチン療法では、HLA拘束性のため、患者が限定されるとともに、CD8T細胞の誘導だけでは、臨床効果が不十分な症例も見られます。そこで、私達の研究室では従来のがんワクチンの問題点を解消し、自然免疫・獲得免疫さらには記憶免疫を誘導できるがんワクチンの開発研究を進めてきました。応用研究といっても、その根本となるコンセプトは基礎研究の中から生まれるものです。この「エーベック」のコンセプトも、背景に述べた生体内における活性化NKT細胞と樹状細胞の相互作用を研究する中から生まれました。
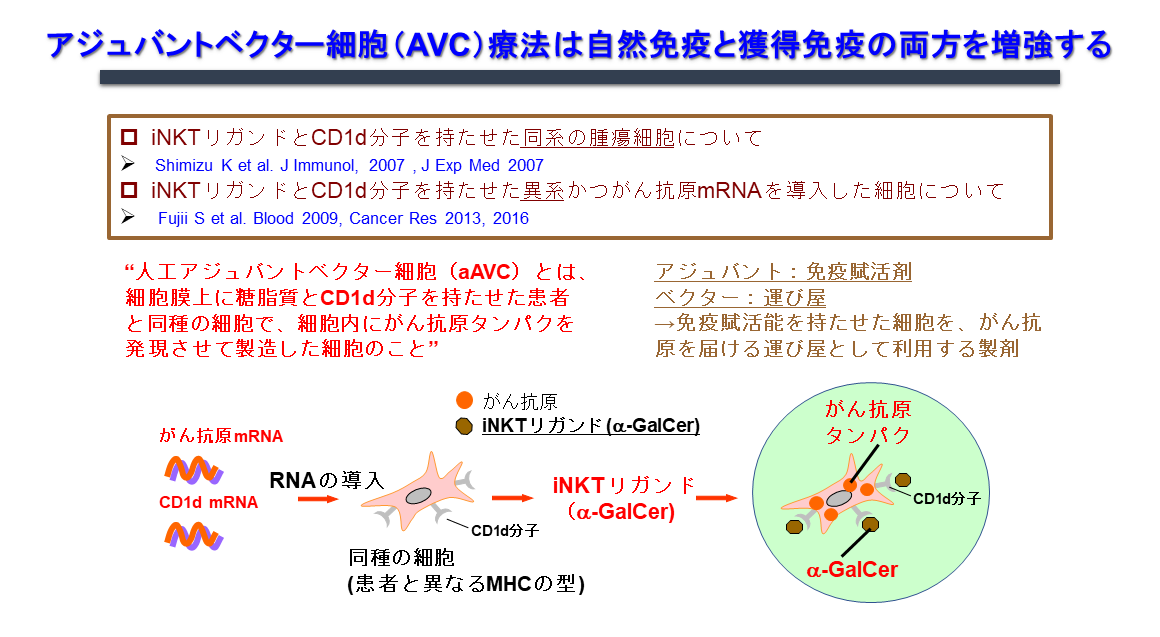
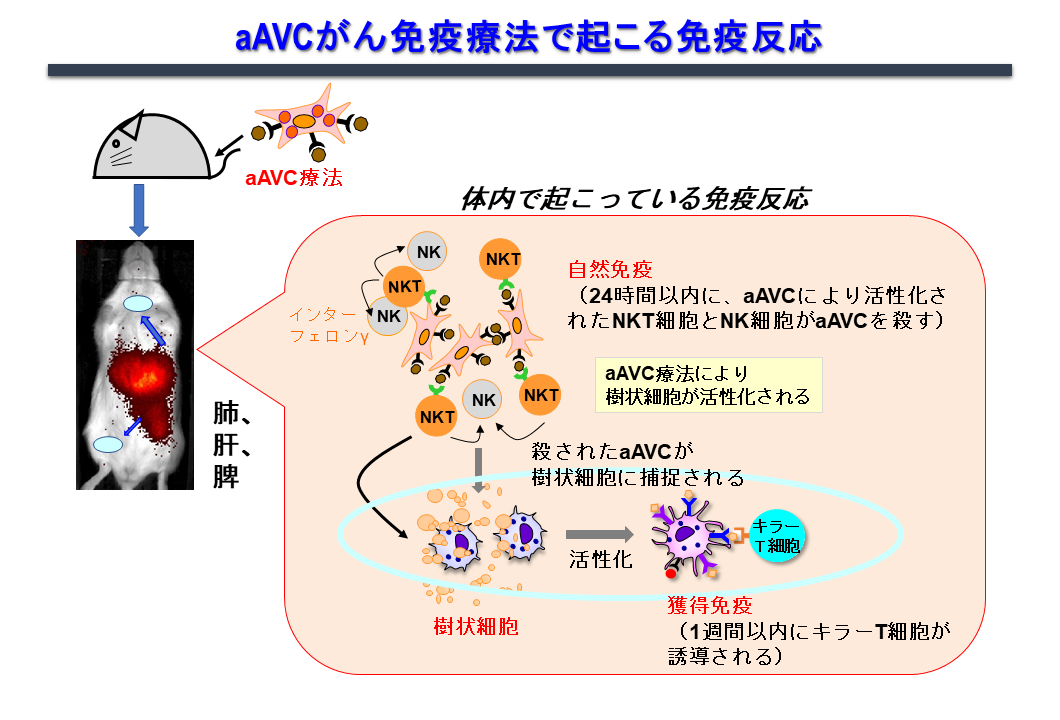
活性化iNKT細胞が樹状細胞の成熟化、さらには獲得免疫を誘導する免疫機構を最大限利用したがんワクチンの開発に取り組んできました。その結果、CD1d発現細胞に腫瘍抗原とiNKTリガンド(α-GalCer)を同時に発現させることにより、NK細胞、iNKT細胞などの自然リンパ球の活性化と抗原特異的なT細胞を最も効率良く誘導し、抗腫瘍効果を示すことがわかってきました。このような2つの抗原を発現している細胞は、標的抗原(蛋白抗原と糖脂質抗原)を同時に生体の樹状細胞へ運びうる「ベクター」機能を有する細胞であり、樹状細胞を活性化・成熟化させる「アジュバント」との機能を併せ持つということで「アジュバントベクター細胞」と名付けました(図4)。もっとも簡単なモデルは、細胞そのものががん抗原を発現している腫瘍細胞(tumor/Gal)を利用した自家アジュバントベクター細胞です。更に他家細胞を利用して、汎用化できるように改良したのが「人工アジュバントベクター細胞(エーベック)」です。免疫機構からの点から見ると、この2つの自己細胞由来、或いは他家細胞由来のアジュバントベクター細胞を用いたワクチンは、生体内樹状細胞の働きを最大限高めるため、生体内樹状細胞標的療法と言えます(図5)。
1.3. エーベックのアプリケーション
エーベックの標的抗原は入れ替え可能なため、これまで種々のモデル抗原、がん抗原、ウイルス抗原(OVA, WT1, Trp2, MART-1, NY-ESO-1, Influenza HA, SARS-CoV-2 Spikeなど)を用いて抗原特異的なT細胞応答を検証してきました。現在も種々がん抗原、ウイルス抗原を発現したエーベックの開発を行っています。
References
13. Fujii S, Kawamata T, Shimizu K, et al. Reinvigoration of innate and adaptive immunity via therapeutic cellular vaccine for patients with AML. Mol Ther Oncolytics in press.
12. Shimizu K, Ueda S, Kawamura M, Satoh M, Fujii S. A single immunization with cellular vaccine confers dual protection against SARS-CoV-2 and cancer. Cancer Sci. 2022, 113(8):2536-2547.
11. Fujii S, Yamasaki S, Hanada K, Ueda S, Kawamura M and Shimizu K. Cancer immunotherapy using artificial adjuvant vector cells to deliver NY-ESO-1 antigen to dendritic cells in situ. Cancer Sci 2022, 113(3):8640874.
10. Yamasaki S, Shimizu K, Kometani K, Sakurai M, Kawamura M, and Fujii S*.
In vivo dendritic cell targeting cellular vaccine induces CD4+ Tfh cell-dependent antibody against influenza virus. Sci Rep. 2016, 6:35173.
9. Shimizu K, Yamasaki S, Shinga J, Sato Y, Watanabe T, Ohara O, Kuzushima K, Yagita H, Komuro Y, Asakura M, and Fujii S*. Systemic DC activation modulates the tumor microenvironment and shapes the long-lived tumor-specific memory mediated by CD8+ T cells. Cancer Res. 2016, 76:3756-66.
8. Shimizu K, Asakura M, Shinga J, Sato Y, Kitaha Shimizu K, Asakura M, Shinga J, Sato Y, Kitahara S, Hoshino K, Kaisho T, Schoenberger SP, Ezaki T, Fujii S*. Invariant NKT cells induce plasmacytoid DC cross-talk with conventional DCs for efficient memory CD8+ T cell induction. J Immunol. 2013, 190:5609-5619.
7. Shimizu K, Mizuno T, Shinga J, Asakura M, Kakimi K, Ishii Y, Masuda K, Maeda T, Sugahara H, Sato Y, Matsushita H, Nishida K, Hanada KI, Dörrie J, Schaft N, Bickham K, Koike H, Ando T, Nagai R, Fujii S*. Vaccination with antigen-transfected, NKT cell ligand-loaded, human cells elicits robust in situ immune responses by dendritic cells. Cancer Res. 2013, 73:62-73.
6. Fujii S*, Goto A, Shimizu K. Antigen mRNA-transfected, allogeneic fibroblasts loaded with NKT-cell ligand confer antitumor immunity. Blood. 2009, 113:4262-72.
5. Shimizu K, Kurosawa Y, Taniguchi M, Steinman RM, Fujii S*. Cross-presentation of glycolipid from tumor cells loaded with α-galactosylceramide leads to potent and long-lived T cell mediated immunity via dendritic cells. J Exp Med. 2007, 204: 2641-53.
4. Shimizu K, Goto A, Fukui K, Taniguchi M, Fujii S*. Tumor Cells Loaded with α-Galactosylceramide Induce Innate NKT and NK Cell-Dependent Resistance to Tumor Implantation in Mice. J Immunol. 2007, 178: 2853-61.
3. Fujii S, Liu K, Smith C, Bonito AJ, and Steinman RM. The linkage of innate to adaptive immunity via maturing dendritic cells in vivo requires CD40 ligation in addition to antigen presentation and CD80/86 costimulation. J Exp Med. 2004, 199: 1607-1618.
2. Fujii S, Shimizu K, Smith C, Bonifaz L, and Steinman RM. Activation of natural killer T cells by α-galactosylceramide rapidly induces the full maturation of dendritic cells in vivo and thereby acts as an adjuvant for combined CD4 and CD8 T cell immunity to a co-administered protein. J Exp Med. 2003, 198: 267-279.
1. Fujii S, Shimizu K, Kronenberg M and Steinman R.M. Prolonged IFN-γ-producing NKT response induced with α-galactosylceramide-loaded DCs. Nat Immunol. 2002, 3: 867-874
[Review]
10. Fujii S, Shimizu K. Immune Networks and Therapeutic Targeting of iNKT Cells in Cancer. Trends Immunol. 2019, 40:984-97.
9. Fujii S, Yamasaki S, Sato Y, Shimizu K. Vaccine Designs Utilizing Invariant NKT-Licensed Antigen-Presenting Cells Provide NKT or T Cell Help for B Cell Responses. Front Immunol. 2018, 9:1267.
8. Fujii S and Shimizu K. Exploiting antitumor immunotherapeutic novel strategies by deciphering the cross talk between invariant NKT cells and dendritic cells. Front Immunol. 2017, 8:886.
7. Fujii S, Shimizu K, Okamoto Y, Kunii N, Nakayama T, Motohashi S, Taniguchi M. NKT Cells as an Ideal Anti-Tumor Immunotherapeutic. Front Immunol. 2013, 2;4:409
6. Fujii S and Shimizu K. Immunotherapy with artificial adjuvant vector cells (aAVCs): harnessing both arms of the immune response. OncoImmunol. 2013, 2:e23432.
5. Fujii S, Motohashi S, Shimizu K, Nakayama T, Yoshiga Y, Taniguchi M. [Review] Adjuvant activity mediated by iNKT cells. Semin Immunol. 2010, 22:97-102.
4. Shimizu K, Fujii S. An adjuvant role of in situ dendritic cells (DCs) in linking innate and adaptive immunity. Front Biosci. 2008;13:6193-201.
3. Fujii S. Exploiting dendritic cells (DCs) and NKT cells in immunotherapy against malignancies. Trends Immunol. 2008, 29:242-9.
2. Fujii S, Shimizu K, Hemmi H, Steinman RM. Innate Valpha14(+) natural killer T cells mature dendritic cells, leading to strong adaptive immunity. Immunol Rev. 2007, 220:183-98.
1. Munz C, Steinman RM, Fujii S. Dendritic cell maturation by innate lymphocytes: coordinated stimulation of innate and adaptive immunity. J Exp Med. 2005, 202:203-207.
2. 記憶免疫の解明
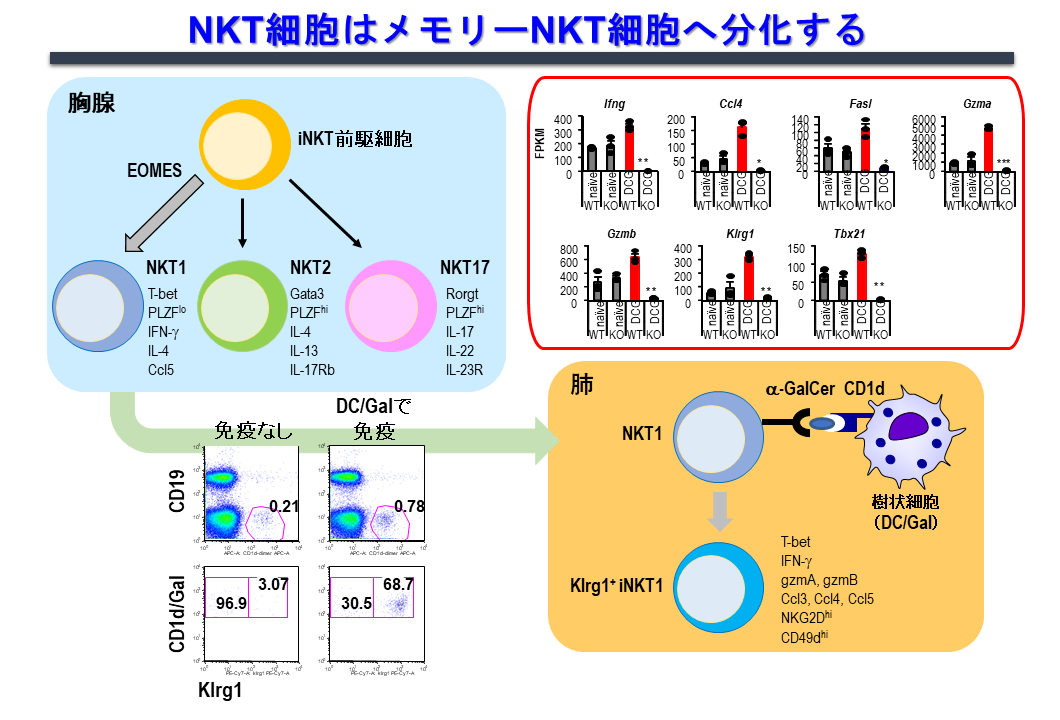
2.1 自然免疫の記憶機構(メモリーNKT細胞)
自然免疫リンパ球として知られる、NK細胞、γδT細胞、iNKT細胞は、免疫学的に非特異的、即時的作用すると考えられてきましたが、このような自然免疫系の細胞も、抗原に反応する記憶免疫サブセットが同定されております。
当研究室ではα-GalCerをパルスした樹状細胞(DC/Gal)を投与後のマウスのiNKT細胞のエフェクター機能を経時的に詳細に調べ、iNKT細胞にメモリー細胞が存在するか、という研究を行いました。その結果、感作刺激後9ヶ月以上という長期に渡って生存し、二度目の刺激に対して迅速かつ強力に反応する、メモリーiNKT細胞サブセットが存在することを発見しました(図6)。一方で、このメモリーiNKT細胞誘導は、上記エーベック作製の際に使用した「CD1d発現させα-GalCerを提示させたアロの線維芽細胞」でも同様なNKT細胞を誘導しうるので、糖脂質抗原依存性で、ワクチンに用いた樹状細胞由来分子に依存した免疫反応ではない事も同時に明らかにしました。
メモリーiNKT 細胞の特徴を調べたところ、細胞表面にキラー細胞レクチン様受容体サブファミリーGメンバー1(KLRG1)を発現していること、抗腫瘍作用をもつサイトカインIFN-γを多く産生すること、TCRレパトア解析によって特定のクローンの蓄積が認められることがわかりました(図6)。さらに、メモリーiNKT 細胞の抗腫瘍作用を検証しところ、DC/Gal免疫後、4ヶ月後にマウスB16悪性黒色腫を静脈内投与した肺転移モデルで黒色腫の転移の抑性が認められました。この抗腫瘍作用が、主にメモリーiNKT細胞の関与によることを確認しております。自然免疫リンパ球と考えられていたiNKT細胞も、このような特徴をもったメモリーiNKT細胞が存在することを示した新しい発見です。現在はiNKT細胞の記憶化の分子生物学的機構の解明をテーマに研究を行っています。
2.2 記憶T細胞誘導、維持機構
メモリーT細胞誘導を規定する因子、メモリーT細胞のサブセット、機能をテーマにマウスおよびヒト研究を行っています。一般にワクチンの効果として、一時的なエフェクター細胞の誘導に留まるだけでなく、長期に渡るメモリーT細胞が誘導できるかどうかは、その再発予防と言う面で重要なポイントです。そこでOVA抗原を発現したエーベック(aAVC-OVA)をマウスに投与し1年後に解析したところ、全身性に、リンパ組織(リンパ節、脾臓・骨髄)だけではなく、非リンパ組織(肺・肝臓)にもメモリーキラーT細胞が維持されており、再度同じ抗原に遭遇すると、このメモリーT細胞は増幅できることがわかりました(図7)。
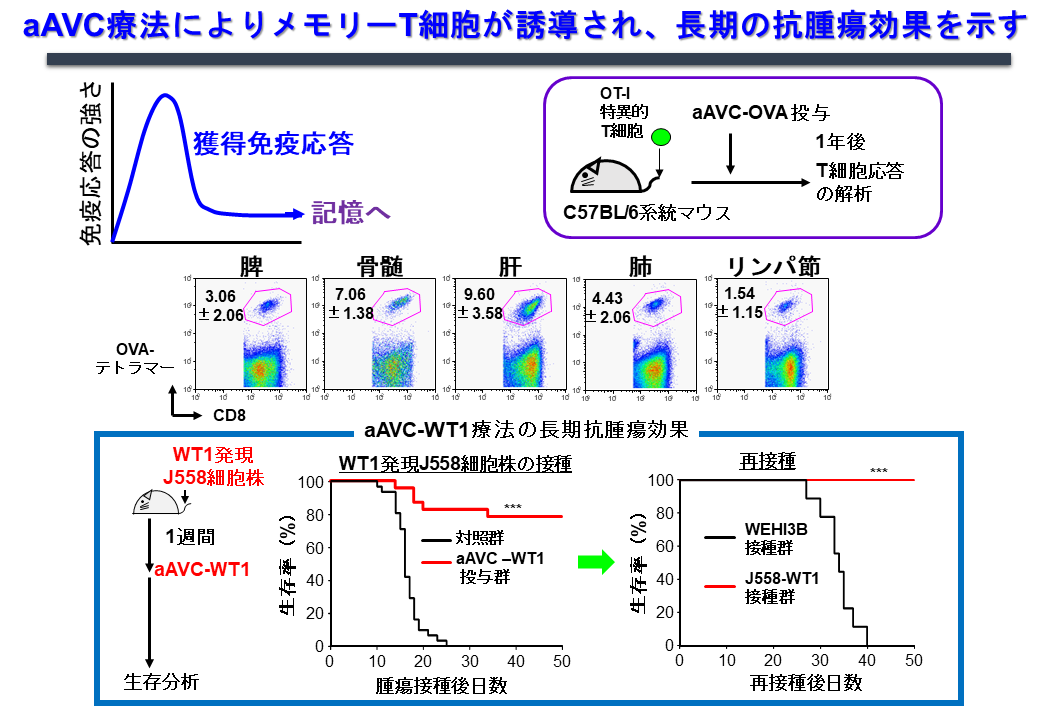
特にヒト研究としてはaAVC-WT1臨床治験において、長期にフォローできた患者さんでは、WT1抗原のペプチドライブラリーを用いて、経時的に免疫応答をモニタリングし、ペプチドライブラリーに反応するT細胞が増殖し、12カ月後まで続くことを確認しました(図8)。さらに腫瘍局所(骨髄)におけるシングルセルトランスクリプトーム解析、T細胞受容体(TCR)解析を行うことにより、クローンレベルでの追跡が可能であることを検証しました(図9)。
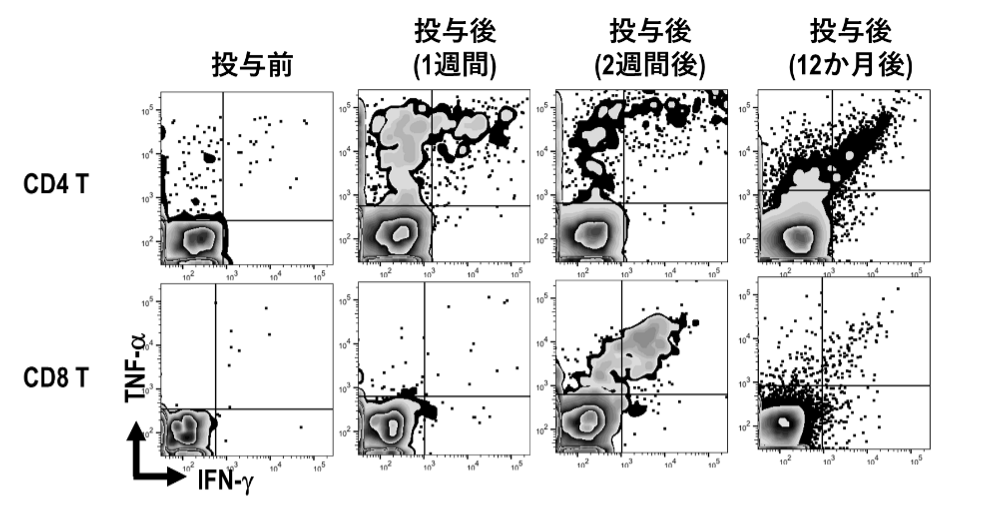
aAVC-WT1の1回目投与後において、WT1抗原に反応するT細胞を、WT1ペプチドライブラリーを用いてサイトカイン産生を指標にし、機能的評価を行った。CD4陽性T細胞(ヘルパーT細胞)は1週間後から、CD8陽性T細胞(キラーT細胞)は2週間後から増加し、1年後においても機能的な記憶T細胞が存在していた。
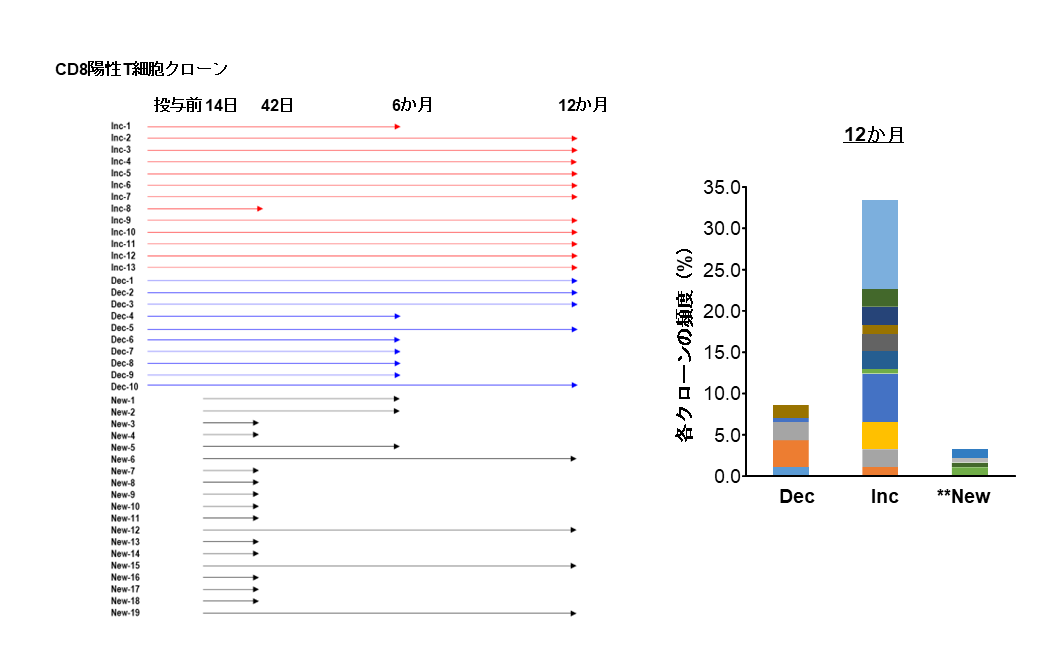
(左)aAVC-WT1療法後キラーT細胞を追跡し、その持続性を評価した。抗腫瘍キラーT細胞クローンの中には、疲弊する前のT細胞(TPEX細胞)から再活性化して増殖するT細胞クローン(Inc、赤矢印)、数的には減少する中で長寿命を示すクローン(Dec、青矢印)、および全く新しく出現するクローン(New、黒矢印)が存在した。
(右)12カ月持続している長期T細胞クローンは、Dec、Inc、Newタイプからなる(縦軸は、それぞれの総T細胞クローン数の割合)。
References
5. Fujii S, Kawamata T, Shimizu K, et al. Reinvigoration of innate and adaptive immunity via therapeutic cellular vaccine for patients with AML. Mol Ther Oncolytics in press.
4. Shimizu K, Sato Y, Kawamura.M, Nakazato H, Watanabe T, Ohara O, Fujii S*. Eomes transcription factor is required for the development and differentiation of invariant NKT cells, Commun Biol. 2019, 2:150.
3. Shimizu K, Yamasaki S, Shinga J, Sato Y, Watanabe T, Ohara O, Kuzushima K, Yagita H, Komuro Y, Asakura M, and Fujii S*. Systemic DC activation modulates the tumor microenvironment and shapes the long-lived tumor-specific memory mediated by CD8+ T cells. Cancer Res. 2016, 76:3756-66.
2. Shimizu K, Sato Y, Shinga J, Watanabe T, Endo T, Asakura M, Yamasaki S, Kawahara K, Kinjo Y, Kitamura H, Watarai H, Ishii Y, Tsuji M, Taniguchi M, Ohara O, Fujii S*. KLRG+ invariant natural killer T cells are long-lived effectors. Proc Natl Acad Sci U S A. 2014, 111:12474-9.
1. Shimizu K, Asakura M, Shinga J, Sato Y, Kitaha Shimizu K, Asakura M, Shinga J, Sato Y, Kitahara S, Hoshino K, Kaisho T, Schoenberger SP, Ezaki T, Fujii S*. Invariant NKT cells induce plasmacytoid DC cross-talk with conventional DCs for efficient memory CD8+ T cell induction. J Immunol. 2013, 190:5609-5619.
3. ネオ抗原に着目した免疫誘導、治療法の開発
がん患者においては、免疫チェックポイント阻害療法(ICB)によって再活性化あるいは増強される腫瘍特異的細胞傷害性CD8T細胞(CTL)の臨床的有用性が広く認識されつつあります。そのCTLが認識する抗原として、自己抗原に比べ腫瘍の体細胞変異に由来するネオ抗原は、腫瘍免疫における理想的な免疫標的といえます。実際ネオ抗原の臨床的意義が明らかにされています。例えば、腫瘍突然変異負荷(Tumor mutational burden; TMB)は、ICB療法の効果予測の指標となる可能性があります。また、DNAミスマッチ修復(MMR)遺伝子欠損腫瘍は、ICB治療が奏功する腫瘍といわれています。故に、ネオ抗原を標的としたワクチンや養子T細胞移植を用いた免疫療法は、革新的な戦略として期待されています。
3.1 Neo antigenの予測システム
ネオアンチジェンエピトープを同定する技術には、がん細胞特異的な遺伝子変異配列からHLA分子に結合すると予測されるペプチドをバイオインフォマティクス技術で選択する方法と、HLA結合ペプチドを直接同定する方法(ペプチドミクス解析)の大きく2つがあります(図10)。以下、両者の現状について述べます。
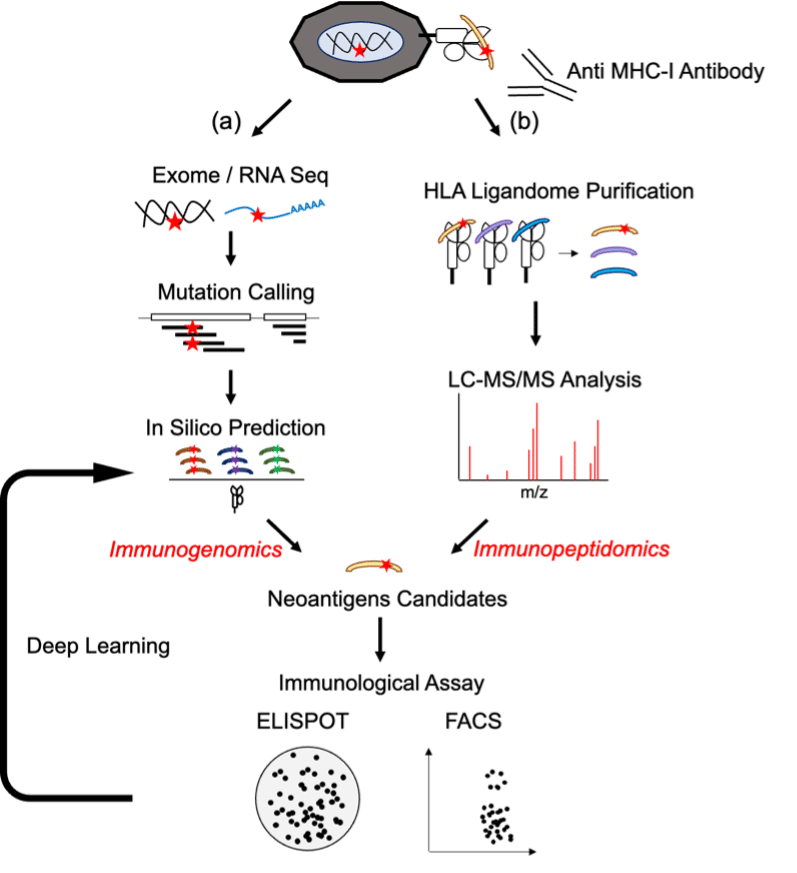
3.2 PD-L1発現とネオ抗原の関連
当研究チームでは、免疫チェックポイント阻害剤の応答予測因子として、がん組織におけるPD-L1発現とネオ抗原を標的とする免疫応答に着目して、その関連性を調べました。免疫応答によって誘導されるPD-L1は免疫チェックポイント阻害剤の応答予測マーカーとして用いられていますが、必ずしも該当しない患者も存在します。その理由を解明するためにマウスモデルを用いてPD-L1発現が低いことで、ネオ抗原に対する免疫応答が増強されていることを見出しました。更に実際に、同定されたネオ抗原を用いた樹状細胞ワクチンが、ネオ抗原特異的T細胞応答を誘導し、免疫チェックポイント阻害剤に匹敵する治療効果を持つことを報告しました。
References
2. Okada M, Shimizu K, Fujii S. Identification of Neoantigens in Cancer Cells as Targets for Immunotherapy. Int J Mol Sci. 2022, 23(5):2594
1. Okada M, Shimizu K, Iyoda T, Ueda S, Shinga, Mochizuki Y, Watanabe T, Osamu O, Fujii S*. PD-L1 expression affects neoantigen presentation, iScience. 2020, 23:101238.
4. 感染症プロジェクト
4.1 COVID-19における交差反応性T 細胞研究
感染症においてその病原体に対する記憶免疫の有無は個々人ならびに集団における流行を左右する因子となります。全く同じ病原体の再感染ではなく、例えば同じウイルス種や株の感染であれば、記憶免疫の交差応答性が機能するかどうかが感染防御の鍵となりえます。今回の新型コロナウイルス感染症(COVID-19)の原因ウイルスであるSARS-CoV-2を始め、ヒトコロナウイルスは、重症急性呼吸器症候群(2002年)、中東呼吸器症候群(2012年)など、重症肺炎を特徴とする人獣共通感染症の流行を定期的に引き起こしています。抗ウイルス免疫には、主に中和抗体と細胞傷害性T細胞(CD8+ T細胞)があり、中和抗体はウイルスを認識・結合することでウイルス感染を防ぐことができますし、CD8+ T細胞は感染細胞のMHCクラスI上のウイルスエピトープを認識、感染細胞を攻撃し、ウイルスを排除することができます。
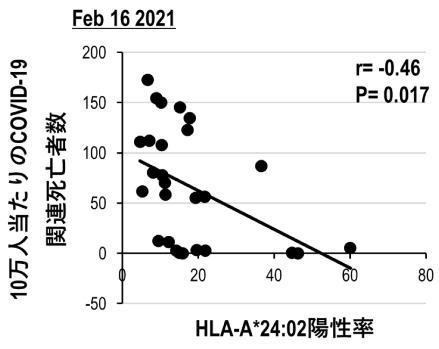
当研究チームでは、SARS-CoV-2に対する免疫反応において、HLAアリルとCOVID-19の関係を理解するために、欧米人に多いタイプ(HLA-A*02:01)と日本人に多いタイプ(HLA-A*24:02)の2つのHLA集団の各国の頻度とWHOのデータベースから人口10万人当たりのCOVID-19関連死亡者数を比較したところ、人口10万人当たりのCOVID-19関連死亡数とHLA-A*24:02陽性率は逆相関となり(図11)、HLA-A*02:01にはそのような関連性は認めらないことを見出しました。HLA Class Iによるこのような違いはCD8+T細胞の免疫応答を反映していると考えられたため、HLA-A*24:02に着目し、交差反応性T細胞の研究を行っています。
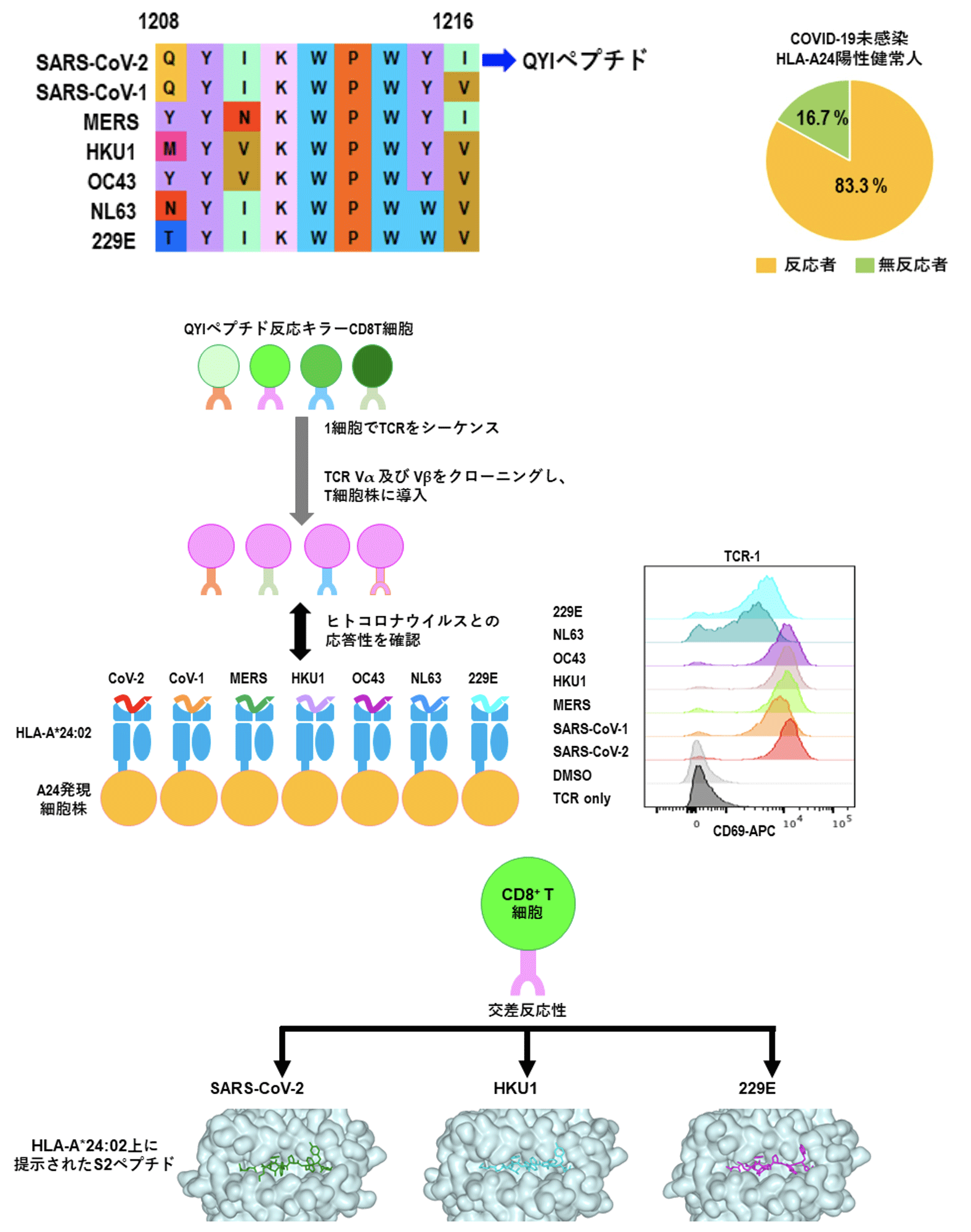
これまでHLA-A*24:02にアフィニテイの高いエピトープの中から、季節性コロナウイウルスと相同性が高い交差反応性エピトープ、S1208-1216 (QYIKWPWYI; QYI)を同定しました。多くのHLA-A*24:02陽性健常人はこのQYIペプチドに対する交差反応性CD8+T細胞を保有しており、それは季節性コロナウイルスの過去の感染により誘導されていたメモリーCD8+T細胞が交差反応性を示すこと、TCRレベルでの交差反応性の検証、さらにBDR蛋白質機能・構造研究チームとの共同研究でpeptide-HLAの立体構造の類似性で交差反応性が説明できることを報告しています(図12)。また、QYIペプチドと同じような交差反応性ペプチドが集中しているホットスポット領域を発見し、T細胞型のワクチンの開発を目指しています。
4.2 感染症に対するワクチン開発研究
感染症に対するワクチン基盤としてエーベックを応用した開発を進めています。これまでインフルエンザHA抗原を発現したaAVC-HAを作製し、動物実験で抗原特異的CD4Tfhを介したHA抗原特異的抗体の産生誘導、インフルエンザ感染モデルでの感染防御効果を報告してきました。またDMPのサポートを受け、aAVC-CoV-2 (Spike 抗原を発現したエーベック)を開発し、Spike 抗原特異的T細胞応答、抗体産生誘導も検証しています。これはCOVID-19に対する担がん患者などのハイリスク群を対象とした次世代のワクチンとしての開発を目指しています。
References
3. Fujii S, Yamasaki S, Iyoda T, Shimizu K. Association of cellular immunity with severity of COVID-19 from the perspective of antigen-specific memory T cell responses and cross-reactivity. Inflamm Regen. 2022, 42:50.
2. Shimizu K, Ueda S, Kawamura M, Satoh M, Fujii S. A single immunization with cellular vaccine confers dual protection against SARS-CoV-2 and cancer. Cancer Sci. 2022 ,113:2536-2547.
1. Shimizu K, Iyoda T, Sanpei A, Nakazato H, Okada M, Ueda S, Kato-Murayama M, Murayama K, Shirouzu M, Harada N, Hidaka M and Fujii S. Identification of TCR repertoires in functionally competent cytotoxic T cells cross-reactive to SARS-CoV-2. Commune Biol. 2021, 4:1365.
